Принцип действия гальванического элемента не изменился со времен его изобретения и не изменится никогда. Основа его работы – протекание на электродах окислительно-восстановительной реакции. Для того чтобы понять причину возникновения разности потенциалов, рассмотрим реакцию металлического цинка с раствором сульфата меди(II). Цинк, как более активный металл, вытесняет медь из раствора соли:
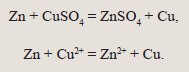
Данная реакция является окислительно-восстановительной. Атомы металлического цинка, отдавая по два электрона, переходят в раствор в виде катионов

Атомы цинка передают свои электроны катионам меди, в результате чего они восстанавливаются, превращаются в атомы металла:

При внесении металлического цинка в раствор сульфата меди(II) электроны переходят непосредственно от атомов цинка к катионам меди. А что если пространственно отделить процесс окисления цинка от процесса восстановления меди, заставив электроны перебегать от цинка к катионам меди по электрическому проводнику? В этом случае за счет протекания химической реакции можно получить электрический ток!
Устройство для получения электрического тока за счет протекания химических реакций называется гальваническим элементом. Свое название такие устройства получили по имени итальянского естествоиспытателя Л.Гальвани, впервые наблюдавшего возникновение электрического тока при контакте двух различных металлов (рис. 8).
 Один из первых гальванических элементов был создан в 30-х гг. XIX в. независимо друг от друга английским исследователем Д.Даниелем и русским ученым Б.С.Якоби. Элемент Даниеля–Якоби представляет собой сосуд, разделенный полупроницаемой мембраной на два отделения. В левом находится раствор соли цинка, в которую погружена цинковая пластинка, в правом – раствор соли меди и медная пластинка. Пластинки соединены между собой в электрическую цепь. Катионы цинка, покидая пластинку, переходят в раствор, а их электроны по цепи перемещаются на медную пластинку, на которой происходит восстановление катионов меди из раствора. В элементе возникает электрический ток, вольтметр показывает разность потенциалов, близкую к 1 В (рис. 9).
Один из первых гальванических элементов был создан в 30-х гг. XIX в. независимо друг от друга английским исследователем Д.Даниелем и русским ученым Б.С.Якоби. Элемент Даниеля–Якоби представляет собой сосуд, разделенный полупроницаемой мембраной на два отделения. В левом находится раствор соли цинка, в которую погружена цинковая пластинка, в правом – раствор соли меди и медная пластинка. Пластинки соединены между собой в электрическую цепь. Катионы цинка, покидая пластинку, переходят в раствор, а их электроны по цепи перемещаются на медную пластинку, на которой происходит восстановление катионов меди из раствора. В элементе возникает электрический ток, вольтметр показывает разность потенциалов, близкую к 1 В (рис. 9).
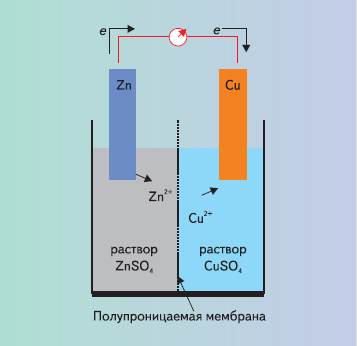
Рис. 9. Схема гальванического элемента Даниеля–Якоби
Поистине трудно переоценить значение этого открытия. Невозможно представить себе современную жизнь без гальванических элементов – химических источников тока, от крохотных батареек до огромных аккумуляторов. Если заменить в гальваническом элементе медную пластинку на серебряную, разность потенциалов в цепи будет больше. Эта величина зависит от природы металлов и вполне может служить количественной характеристикой их активности. Для таких измерений в пару с металлическим электродом в цепь включают так называемый водородный электрод, потенциал которого условно принят за ноль. Таким образом, по величине потенциала на металлическом электроде все металлы располагают в знакомый вам ряд, называемый электрохимическим рядом напряжений:
Li K Ca Na Mg Al Mn Zn Fe Ni Sn Pb H2 Cu Hg Ag Au.
При изготовлении современных портативных гальванических элементов, которые мы привыкли называть батарейками, для увеличения площади поверхности электродов их выполняют в виде электропроводного порошка («активной массы»), а электролит – в виде густой пасты для предотвращения его вытекания (рис. 10, см. с. 16). К сожалению, при замыкании внешней цепи гальванического элемента (например, включении сотового телефона) на катоде восстанавливается окислитель, и его концентрация в околокатодном пространстве снижается, на аноде окисляется восстановитель, его концентрация также уменьшается. При этом разность потенциалов элемента падает, батарейка «садится».
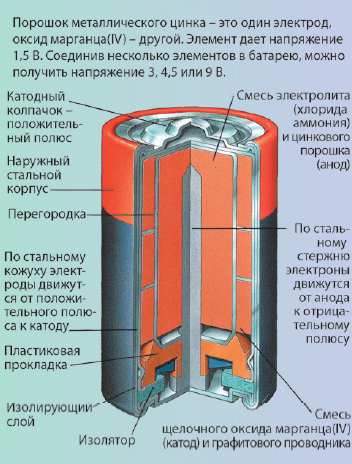
Рис. 10. Устройство сухого щелочного элемента
Нельзя ли восстановить батарейку, продлить ее жизнь заставить работать снова? Можно, если электродные реакции в ней обратимы. В этом случае достаточно пропустить через элемент электрический ток от внешнего источника, восстановить окислившийся на аноде восстановитель, окислить принявший на катоде электроны окислитель. При пропускании «встречного» (подумайте, почему его так называют) тока через химический источник тока разность его потенциалов растет, он запасает, аккумулирует энергию или, как говорят, «заряжается». Подобные гальванические элементы так и называются – аккумуляторы.
Рис. 11. Внутреннее устройство свинцового аккумулятора (а) – рисунок из учеб-
ника прошлого века; схема одного элемента аккумуляторной батареи (б)
Любому автомобилисту, да и не только, известен один из самых распространенных аккумуляторов – свинцовый (рис. 11). Его отрицательно заряженный электрод изготовлен из свинца, а положительно заряженный – из пористой массы оксида свинца(IV), смешанной с сульфатом свинца(II). Электролитом служит раствор серной кис-
лоты. При замыкании внешней электрической цепи (разряде аккумулятора) на его электродах идут процессы восстановления свинца Рb4+ и окисления свинца
Pb0, а концентрация кислоты в электролите снижается:
Суммарная окислительно-восстановительная реакция, протекающая при работе свинцового аккумулятора, следующая:
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O.
Разность электродных потенциалов, т.е. ЭДС гальванического элемента составляет примерно 2 В. Поэтому в автомобильном аккумуляторе для достижения напряжения 12 В последовательно соединены 6 одинаковых элементов. Поскольку при разрядке аккумулятора концентрация серной кислоты понижается, плотность электролита также
снижается.
При пропускании электрического тока от внешнего источника (например, генератора автомобиля) в противоположном направлении электрод, бывший анодом (–), начинает восстанавливать ионы свинца, а электрод, бывший катодом (+), окисляет эти ионы. Происходит зарядка аккумулятора, при которой на электродах протекают обратные процессы. При этом концентрация кислоты в электролите растет.
Таким образом, работа аккумулятора наглядно демонстрирует превращение энергии электрического тока во внутреннюю энергию вещества – энергию химических связей и обратный процесс – получение электрической энергии в ходе электродных реакций.В современных электронных приборах широко используются миниатюрные литиевые и металлгидридные аккумуляторы.
Приведенные выше примеры – далеко не полный перечень возможностей использования электрохимических процессов. В медицине широко применяются
такие методы лечебного воздействия, как гальванизация и электрофорез.
Гальванизация – действие постоянным током небольшой силы и напряжения – оказывает болеутоляющее действие, улучшает периферическое кровообращение, способствует восстановлению пораженных тканей, особенно нервной, стимулирует регуляторную функцию нервной системы. Лечебный электрофорез (направленное движение коллоидных частиц или ионов лекарства) – комбинированное лечебное действие на организм постоянного электрического тока и вводимых им через кожу или слизистые оболочки компонентов лекарственных препаратов. При электрофорезе повышается чувствительность рецепторов к лекарству, достигается локализация препарата в нужной области организма и увеличивается продолжительность его терапевтического действия, что позволяет снизить дозу лекарства без снижения лечебного действия.
Электрофорез применяют при лечении центральной и периферической нервной системы, гинекологических заболеваниях и болезнях опорно-двигательного аппарата; гальванизацию применяют при поражениях периферической нервной системы (радикулиты, невриты, невралгии), головного и спинного мозга, невротических состояниях, воспалениях суставов (артритах) и др. Более подробно об использовании электрохимических процессов в медицине вы узнаете из материалов следующей главы учебника.
Кроме медицины, электрофорез используют для выделения каучука из латекса, очистки воды, анализа и разделения белков, аминокислот, витаминов, бактериальных клеток и вирусов.
? 1. Что такое гальванический элемент? Почему его так называют?
2. Каков принцип действия гальванического элемента? Как устроен гальванический элемент Даниеля–Якоби?
3. Как эффективность работы гальванического элемента зависит от положения его металлов в электрохимическом ряду напряжений?
4. Расскажите об устройстве сухого щелочного гальванического элемента.
5. Каков принцип работы аккумулятора? Рассмотрите устройство и работу свинцового аккумулятора. Применим ли принцип Ле Шателье к его работе?
6. Что такое гальванизация? Где она применяется?
7. Что такое электрофорез? Каково его применение в медицине и промышленности?
8. Какие аккумуляторы применяются в электронных приборах (мобильных телефонах, ноутбуках и др.)? Для подготовки ответа на это задание используйте технические паспорта приборов или воспользуйтесь возможностями Интернета.
9. Подготовьте сообщение о жизни и деятельности Л.Гальвани, Д.Даниеля, Б.С.Якоби (по собственному выбору), используя возможности Интернета.
10. Подготовьте сообщение об эволюции батареек, используя возможности Интернета.
11. Подготовьте сообщение об эволюции аккумуляторов, используя возможности Интернета.









