Химические реакции, или химические явления, – это процессы, в результате которых из одних веществ образуются другие, отличающиеся от исходных по составу или строению, а, следовательно, и по свойствам.
В основу классификации химических реакций могут быть положены самые различные признаки. Один из них – изменение состава вещества. Но имеется достаточно большая группа реакций, которые не сопровождаются изменением состава веществ. В неорганической химии к таким реакциям можно отнести процессы взаимопревращения различных аллотропных модификаций химического элемента.
Аллотропными модификациями, или видоизменениями называются простые вещества, образованные одним химическим элементом, а явление их существования называется аллотропией.
Очень интересно, а в настоящее время и практически значимо, например превращение одной аллотропной модификации углерода (графита) в другую (алмаз):
С (графит) -> С (алмаз).
Как вы уже знаете, обе аллотропные модификации углерода – и алмаз, и графит, – имеют атомную кристаллическую решетку, но разной геометрии: у алмаза она объемная тетраэдрическая, а у графита – плоскостная.
Процесс изменения геометрии кристаллической решетки графита используется для получения искусственных алмазов. В 1954 г. ученые из лаборатории знаменитой американской фирмы «Дженерал Электрик» получили черные кристаллики искусственных алмазов массой 0,05 г при экстремальных условиях: давлении 100 000 атм и температуре 2600 °С. Такие алмазы стоили в сотни раз дороже природных. Но затем в течение 10 лет были разработаны технологии, позволяющие получить в одной камере за несколько минут 20 и более граммов алмазов. Современное производство искусственных алмазов основано на их получении из графита не только при сверхвысоких, но и при низких давлениях. Искусственные алмазы сравнительно дешевы, используются преимущественно в технических целях: в металлургии и машиностроении, радиоэлектронике и приборостроении, геологоразведке и горной промышленности.
В истории химии яркий след оставило изучение аллотропии фосфора. Для наиболее известных его модификаций взаимопревращения можно отразить следующей схемой:
Р (белый) -> Р (красный).
Фосфор красный имеет атомную кристаллическую решетку, а фосфор белый – молекулярную и, соответственно, можно записать его формулу Р4.
Немецкий алхимик Г.Брандт в 1669 г., пытаясь получить так называемый философский камень прокаливанием сухого остатка мочи, получил светящиеся белые кристаллики вещества, названного им фосфором (от греч. phōsphόros – несущий свет) (рис. 1).

Рис. 1. Репродукция картины Дж.Райта «Алхимик
Г.Брандт открывает фосфор»
Покорители Южного полюса Земли не учли взаимопревращение аллотропных модификаций олова:
Sn (белое) -> Sn (серое).
Белое олово – это мягкий пластичный металл. Именно с ним мы чаще всего и сталкиваемся. Однако при понижении температуры металл может превращаться в порошок (серое олово) со всеми свойствами неметаллов. Этот переход катализируется самим серым оловом: достаточно появиться всего лишь одной пылинке серого олова, как начинается процесс, который уже невозможно остановить. При этом изделие из белого блестящего металла рассыпается. Такое явление носит образное название «оловянная
чума». Именно она и стала причиной гибели экспедиции Р.Скотта, пытавшегося в 1912 г. покорить Южный полюс. Путешественники использовали для хранения
продуктов и керосина железные канистры, запаянные оловом. На сильном морозе оловянный припой рассыпался, и экспедиция осталась без топлива.
В основу классификации химических реакций, протекающих с изменением состава вещества, могут быть положены самые различные признаки.
1. Число и состав реагентов и продуктов реакции.
Реакции соединения – это такие реакции, в результате которых из двух и более веществ образуется одно сложное вещество.
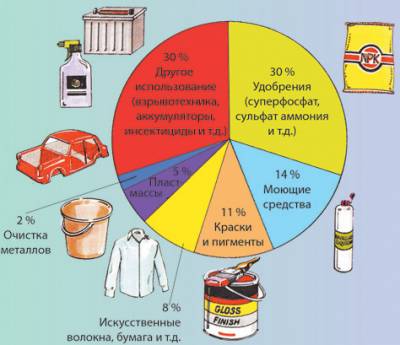
Многообразие реакций соединения можно рассмотреть на примере получения серной кислоты из серы.
Мы выбрали этот пример не только потому, что он максимально иллюстрирует «палитру» реакций соединения, но также и потому, что продукт этих реакций – серная кислота – по образному выражению Д.И.Менделеева является «хлебом химической промышленности» (рис. 2).
Реакции разложения – это такие реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
Многообразие таких реакций можно рассмотреть на примере получения кислорода лабораторными способами.
1) Разложение оксида ртути(II):
2HgO = 2Hg + O2↑.
Именно этим способом Дж.Пристли впервые получил кислород (рис. 3).
Рис. 3. Разложение оксида ртути
2) Разложение пероксида водорода (рис. 4):
кат.
2Н2О2 == 2Н2О + О2↑.
Рис. 4. Разложение пероксида водорода при внесении катали-
затора – оксида марганца(IV)
3) Разложение перманганата калия:
2KMnO4 =t K2MnO4 + MnO2 + O2↑.
Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
Примером таких процессов может служить блок реакций, характеризующих, например, свойства металлов.
1) Взаимодействие щелочных и щелочно-земельных металлов с водой (рис. 5):
2Na + 2H2O = 2NaOH + H2↑.
2) Взаимодействие металлов с кислотами в растворе (рис. 6):
Zn + 2HCl = ZnCl2 + H2↑.
3) Взаимодействие металлов с солями в растворе (рис. 7):
Fe + CuSO4 = Cu + FeSO4.
Рис. 5. Взаимодействие натрия с водой

Рис. 6. Взаимодействие соляной
кислоты с различными металлами

Рис. 7. Реакция замеще-
ния меди железом
4) Металлотермия – вытеснение более активными металлами менее активных из их оксидов, например (рис. 8):
t
2Al + Fe2O3 = Al2O3 + 2Fe.
Рис. 8. Алюминотермия
Реакции обмена – это такие реакции, в результате которых два сложных вещества обмениваются своими составными частями.
Протекание реакции обмена в растворе возможно только в случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, вода).
1) В результате реакции обмена между растворами йодида натрия и нитрата свинца образуется красивый золотисто-желтый осадок йодида свинца (рис. 9):
2NaI + Pb(NO3)2 = PbI2↓ + 2NaNO3.
Рис. 9. Образование осадка йодида свинца
2) Если в раствор кислоты прилить раствор карбоната металла, то можно заметить образование пузырьков газа:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
3) Если к раствору щелочи добавить несколько капель фенолфталеина (окраска станет малиновой), а затем прилить кислоты, раствор обесцветится, т.к. произойдет не просто реакция обмена, а реакция нейтрализации:
KOH + HNO3 = KNO3 + H2O.
2. Выделение или поглощение теплоты. Почти все реакции соединения протекают с выделением теплоты.
Реакции, протекающие с выделением теплоты, называются экзотермическими.
Частным случаем экзотермических реакций являются реакции горения.
Реакция горения магния – магниевая вспышка (рис. 10):
2Mg + O2 = 2MgO + Q.

Рис. 10. Горение
магния
Ее использовали в начале ХХ в. фотографы:
Как магния синяя вспышка,
И детство, и юность – момент.
Вчерашний соседский мальчишка –
«Наш собственный корреспондент».
Е.Долматовский
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
За небольшим исключением почти все реакции разложения являются эндотермическими. Например, обжиг известняка:
t
СаСО3 = СаО + СО2 – Q.
? 1. Какие явления называются химическими? Чем они отличаются от физических явлений?
2. Вспомните из курса химии основной школы признаки и условия течения химических реакций. Приведите примеры.
3. Что такое аллотропия, аллотропные видоизменения?
4. Вспомните аллотропные видоизменения кислорода. Какова природа аллотропии кислорода и природа аллотропии углерода? Сделайте обобщение о причинах, вызывающих явление аллотропии.
5. Сравните свойства и строение аллотропных модификаций фосфора, углерода, олова.
6. На примере аллотропии олова докажите относительность деления простых веществ на металлы и неметаллы.
7. На какие типы делятся реакции в зависимости от состава и числа реагирующих веществ и образующихся продуктов?
8. Что такое реакции соединения? С каким тепловым эффектом они протекают?
9. Что такое реакции разложения? С каким тепловым эффектом они протекают?
10. Чем характеризуются реакции замещения? Запишите уравнения реакций замещения, иллюстрирующих свойства металлов, исходя из их положения в ряду напряжений. Какие особенности взаимодействия металлов с растворами кислот и солей имеют щелочные металлы? Почему?
11. Приведите уравнения реакций обмена, характеризующих химические свойства кислот, в молекулярной и ионной формах. Для ответа на этот вопрос вспомните курс химии основной школы или воспользуйтесь возможностями Интернета.