§ 17. ОБРАТИМОСТЬ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Им приговор почти произнесен.
Но кто нас защитит от ужаса, который
Был бегом времени когда-то наречен?
А.Ахматова
Обратимыми называются химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном.
Среди обратимых реакций, лежащих в основе получения важнейших химических продуктов, можно назвать уже знакомую вам реакцию синтеза аммиака:

Состояние обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамичным (подвижным), т.к. при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов, т.е. за единицу времени образуется такое же количество продуктов реакции, какое превращается в исходные вещества. При постоянных температуре и давлении равновесие обратимой реакции может сохраняться неопределенно долгое время.
На производстве заинтересованы в преимущественном протекании прямой реакции, например в получении аммиака, оксида серы(VI), оксида азота(II). Как же сместить состояние равновесия системы в нужную нам сторону? Как влияет на него изменение внешних условий, при которых протекает тот или иной обратимый химический процесс?
 Французский химик А. Ле Шателье в 1885 г. вывел, а немецкий физик Ф.Браун в 1887 г. обосновал общий законсмещения химического равновесия в зависимости от внешних факторов, который известен под названием принципа Ле Шателье.
Французский химик А. Ле Шателье в 1885 г. вывел, а немецкий физик Ф.Браун в 1887 г. обосновал общий законсмещения химического равновесия в зависимости от внешних факторов, который известен под названием принципа Ле Шателье.
Если изменить одно из условий – температуру, давление или концентрацию веществ, – при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению.
Этот принцип можно было бы назвать принципом «делай наоборот, и добьешься своего». Рассмотрим на примере реакции синтеза аммиака, как нужно поступить, чтобы сместить равновесие в нужную сторону, если изменять каждое из условий реакции.
Вначале дадим характеристику этому процессу.
Анри Луи Ле Шателье
(1850–1936) – французский
физикохимик и металловед,
член Парижской АН, почет-
ный член АН СССР с 1927 г.
1) Прямая реакция является реакцией соединения, т.к. из двух простых веществ – азота и водорода – образуется одно сложное вещество – аммиак. Разумеется, обратная реакция по этому признаку относится к реакциям разложения.
2) Обе реакции – и прямая, и обратная – протекают в присутствии катализатора (им может служить или универсальная, но дорогая платина, или дешевый железный катализатор с добавками оксидов калия и алюминия), следовательно, обе реакции являются каталитическими.
Следует отметить, что катализатор не влияет на смещение равновесия, он одинаково изменяет как скорость прямой, так и скорость обратной реакций – ускоряет момент наступления химического равновесия.
3) Прямая реакция протекает с выделением теплоты, поэтому относится к экзотермическим реакциям. Логично поэтому утверждать, что обратная реакция является эндо-
термической и протекает с поглощением теплоты.
Итак, рассмотрим теперь, как применим принцип Ле Шателье (принцип противодействия) для смещения равновесия реакции синтеза аммиака.
Изменение равновесных концентраций (концентраций веществ после установления равновесия).
Чтобы сместить равновесие в сторону образования аммиака, необходимо увеличить концентрацию исходных веществ – концентрацию азота и водорода и уменьшить концентрацию продукта – аммиака, т.е. вывести его из сферы реакции. Для смещения равновесия влево нужно поступить наоборот.
Изменение давления.
Синтез аммиака из водорода и азота сопровождается уменьшением объема. Из четырех моль исходных веществ образуется только два моль аммиака. Очевидно, что продукты этой реакции создают меньшее давление, чем создавали исходные вещества, значит прямая реакция – синтез аммиака – сопровождается понижением давления.
Наоборот, разложение аммиака на водород и азот ведет к увеличению числа газообразных молекул, а потому и к увеличению давления. При сжатии реакционной смеси равновесие смещается вправо, в сторону образования аммиака, т.к. этот процесс приводит к уменьшению давления, т.е. противодействует внешнему воздействию. Наоборот, уменьшение давления смещает равновесие влево, в направлении разложения аммиака.
Необходимо отметить, что изменение давления смещает равновесие лишь в том случае, если в реакции принимают участие газообразные вещества и она сопровождается изменением количества их молекул. Если же количество молекул газообразных веществ в процессе реакции не изменяется, то увеличение или уменьшение давления не влияет на равновесие такой обратимой реакции.
Изменение температуры.
Мы уже выяснили, что процесс образования аммиака из водорода и азота является экзотермическим, а обратный – разложение аммиака – эндотермическим. При повышении температуры равновесие сместится влево, в направлении реакции разложения аммиака, которая проходит с поглощением теплоты и поэтому ослабляет внешнее воздействие – повышение температуры. Наоборот, охлаждение реакционной смеси смещает равновесие вправо, в направлении реакции синтеза аммиака. Эта реакция
идет с выделением теплоты и противодействует охлаждению.
Следовательно, повышение температуры смещает химическое равновесие в сторону эндотермической реакции, а понижение температуры – в направлении экзотермической реакции.
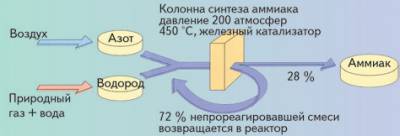
Промышленное производство аммиака осуществляется при значительном давлении и повышенной температуре (см. схему) в аппаратах, которые называются колонна синтеза аммиака (рис. 14).
Как можно убедиться на рассмотренном примере, применение принципа Ле Шателье к обратимым химическим процессам открывает путь к управлению химическими реакциями.
? 1. Какие реакции называются необратимыми? Приведите примеры таких реакций, запишите их уравнения.
2. Какие реакции называются обратимыми? Что такое химическое равновесие? Как его сместить?
3. Дайте характеристику реакции синтеза оксида серы(VI) из оксида серы(IV) и кислорода. Рассмотрите, как нужно изменить концентрацию веществ, давление и температуру, чтобы сместить равновесие вправо.
4. Для смещения равновесия в реакции синтеза аммиака вправо необходимо понизить температуру. Почему же на производстве этот процесс проводят при достаточно высокой температуре 500–550 °С?
5. Что может служить сырьем для производства аммиака? Назовите источники этого сырья, используя возможности Интернета.
Схема
Производство аммиака
6. Используя свои знания по биологии и неорганической химии, охарактеризуйте народнохозяйственное значение аммиака.
7. Приведите примеры обратимых процессов из курсов физики и биологии основной школы. Применим ли к вашим примерам принцип Ле Шателье?
8. Какие процессы в международных отношениях можно назвать необратимыми, а какие - обратимыми? Применим ли к последним принцип Ле Шателье?
9. Подготовьте сообщение о жизни и творчестве Анри Ле Шателье, используя возможности Интернета.
10. Подготовьте сообщение о производстве аммиака, серной и азотной кислот (по своему выбору), используя возможности Интернета.
11. Напишите синквейн о понятиях этого параграфа по своему выбору.