СОДЕРЖАНИЕ
1.1. Модели строения атома.
1.2. Атомные спектры.
1.3. Связь между спектральными линиями и энергиями электронов.
1.4. Волновая природа электрона.
1.5. Орбитали.
1.6. Энергетические уровни и электронная конфигурация атома.
1.7. Магнитные и энергетические характеристики атомов.
1.8. Размеры атома.
1.9. Упражнения.
Глава 1.
Электронное строение атома
1.1. Модели строения атома
К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Джозефом Томсоном в 1903 г. Томсоновская модель «сливового пудинга» (в русском литературном переводе – «булочка с изюмом») уподобляла атом положительно заряженному сферическому пудингу, в который вкраплены отрицательно заряженные шарики – электроны (рис. 1.1).

Рис. 1.1.
Модель атома в виде «булочки с изюмом»
(Дж.Томсон, 1903 г.)
В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме.
Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г. они проводили эксперименты, в которых бомбардировали тонкие листы золотой фольги пучком  -частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство
-частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство  -частиц совершенно свободно проходило через фольгу, причем некоторые из них лишь незначительно отклонялись от первоначального направления. Однако примерно одна из 10 000–100 000 частиц резко изменяла свое направление на противоположное.
-частиц совершенно свободно проходило через фольгу, причем некоторые из них лишь незначительно отклонялись от первоначального направления. Однако примерно одна из 10 000–100 000 частиц резко изменяла свое направление на противоположное.

Рис. 1.2.
Эксперимент Х.Гейгера и Э.Марсдена
Это наблюдение заставило Резерфорда выдвинуть новую модель атома, согласно которой положительно заряженное ядро окружено электронами (рис. 1.3).

Рис. 1.3.
Модель атома с положительно заряженным ядром
и вращающимися вокруг него электронами
(Э.Резерфорд, 1911 г.)
Рассчитанный на основе данных проведенного эксперимента размер ядра атома оказался примерно в 100 000 раз меньше размера самого атома. К примеру, если бы диаметр ядра составлял 1 см, то диаметр атома был бы 1 км. И в этой малой части пространства, занимаемого ядром, сосредоточено более 99,9% массы атома.
После этого Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона. Существование нейтрона было предсказано Резерфордом в 1920 г. Экспериментально нейтрон был обнаружен в 1932 г.
Началом современной теории электронного строения атомов послужила его планетарная квантовая модель, которую в 1913 г. выдвинул Нильс Бор. Обоснованием этой и более поздних моделей атома служат главным образом три источника данных: атомные спектры, энергии ионизации атомов, сродство атомов к электрону.
1.2. Атомные спектры
Всякий спектр представляет собой развертку (разложение) излучения на его составляющие. Для получения и измерения спектров используется специальный прибор – спектрометр. На рис. 1.4 изображен полный спектр электромагнитного излучения.
Видимый свет составляет только небольшую часть всего спектра электромагнитного излучения

Рис. 1.4.
Спектр электромагнитного излучения
и является примером непрерывного (сплошного) излучения. В непрерывном излучении содержатся все длины волн в пределах некоторого диапазона. Примером непрерывного спектра может служить известное всем природное явление – радуга.
Когда пучок непрерывного излучения, например белый свет, пропускают через газообразный образец какого-либо элемента, в прошедшем через образец пучке недостает излучения с определенными длинами волн (рис. 1.5). Спектр поглощенного этим образцом излучения называется атомным спектром поглощения. Волны излучения, поглощенного атомами образца, обнаруживаются по темным линиям на фоне непрерывного спектра после прохождения излучения через дифракционную решетку.

Рис. 1.5.
Устройство спектрометра
Если элементы в их газообразном состоянии нагревать до высоких температур или пропускать через них электрический разряд, они испускают излучение с определенными длинами волн. Спектр такого излучения называется атомным спектром испускания, или атомным эмиссионным спектром. Линии в спектре испускания в точности соответствуют линиям в спектре поглощения. На рис. 1.6 приведен атомный эмиссионный спектр водорода.
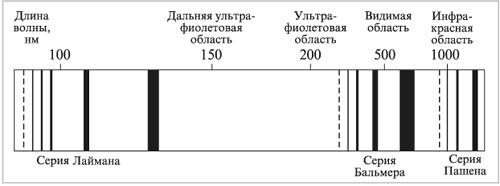
Рис. 1.6.
Спектр испускания атома водорода
(приведены три серии спектральных линий,
относящихся к электронным переходам
из возбужденных состояний
на более низкие уровни энергии)
1.3. Связь между спектральными линиями
и энергиями электронов
Одним из важнейших достижений Н.Бора стал ответ на вопрос, почему атомы газообразных веществ поглощают или испускают излучение с фиксированными длинами волн, а не излучение с непрерывным спектром. Именно Бор установил соответствие между линиями атомного спектра и энергиями электронов. На основе этого Бор предложил в 1913 г. планетарную квантовую модель атома, согласно которой электроны движутся вокруг ядра по стационарным круговым орбитам
(рис. 1.7).

Рис. 1.7.
Планетарная квантовая модель
атома (Н.Бор, 1913 г.)
Такая модель не согласовывалась с законами классической электродинамики, применимыми к макрообъектам, согласно которым электрон неизбежно терял бы энергию и упал бы на ядро. Это противоречие Бор «устранил» следующим образом: предположив, что микрообъекты существуют по своим, им присущим законам, он выдвинул два постулата.
1. Электроны способны находиться в атоме только на некоторых разрешенных стационарных орбитах; по этим орбитам электроны движутся, не испуская и не поглощая энергии.
2. Излучение или поглощение порции (кванта) энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Атомный спектр испускания водорода представляет собой совокупность линий, среди которых можно различить три группы или серии. Серия линий, находящихся в ультрафиолетовой области, называется серией Лаймана. Серия, находящаяся в видимой области, – серия Бальмера, а в инфракрасной – серия Пашена (рис. 1.8).
Серии линий, лежащие в ультрафиолетовой, видимой и инфракрасной областях, описываются единым уравнением:
1/ = P
= P (1/N2 – 1/n2),
(1/N2 – 1/n2),
где  – длина волны, P
– длина волны, P – постоянная Ридберга, N – номер электронного уровня, на который осуществляется переход электрона (для серии Лаймана N = 1, для серии Бальмера N = 2, для серии Пашена N = 3), n – целое число, номер электронного уровня, с которого возбуждается электрон.
– постоянная Ридберга, N – номер электронного уровня, на который осуществляется переход электрона (для серии Лаймана N = 1, для серии Бальмера N = 2, для серии Пашена N = 3), n – целое число, номер электронного уровня, с которого возбуждается электрон.

Рис. 1.8.
Соответствие между электронными переходами
и спектральными линиями атома водорода
Бор связал электронные переходы со спектральными линиями атомарного водорода. Линии каждой серии (см. рис. 1.8) по мере уменьшения длины волны постепенно приближаются к некоторому пределу сходимости. С увеличением номера энергетических уровней наблюдается их сгущение. Так, переход с первого энергетического уровня на второй требует большей энергии, чем со второго на третий, а со второго на третий – большей энергии, чем с третьего на четвертый, и т. д. Пределы сходимости спектральных линий соответствуют энергиям электронов, находящихся на самых высоких энергетических уровнях.
1.4. Волновая природа электрона
Недостатки модели Бора. Выдвинутая Бором модель атома до сих пор используется в ряде случаев. Она применима для объяснения линий в спектре атомарного водорода. Ею можно пользоваться, интерпретируя расположение элементов в периодической таблице и закономерности изменения энергии ионизации элементов. Однако модель Бора имеет недостатки.
1. Эта модель не позволяет объяснить некоторые особенности в спектрах более тяжелых элементов, чем водород.
2. Экспериментально не подтверждается, что электроны в атомах вращаются вокруг ядра по круговым орбитам со строго определенным угловым моментом. Более того, если бы это было так, то электрон должен был бы постепенно терять энергию и замедляться. В конце концов он оказался бы притянутым к ядру, что означает разрушение атома. На самом деле этого не происходит.
Двойственная природа электрона. К 1925 г. было уже известно, что электромагнитное излучение способно проявлять как волновые, так и корпускулярные свойства (подобные свойствам частиц). В последнем случае оно ведет себя как поток частиц – фотонов. Энергия фотона связана с его длиной волны  или частотой
или частотой  соотношением:
соотношением:
E = h = hc/
= hc/  (с =
(с =
 ),
),
где h – поcтоянная Планка, c – скорость света.
Луи де Бройль высказал смелое предположение, что аналогичные волновые свойства можно приписать и электрону. Он объединил уравнения Эйнштейна (E = mc2) и Планка (E = h ) в одно:
) в одно:
h = mc2
= mc2  hс/
hс/ = mc2
= mc2 
 = h/mc.
= h/mc.
Далее, заменив скорость cвета на скорость электрона, он получил:
 = h/m
= h/m ,
,
где  – скорость электрона. Это уравнение, связывающее длину волны с его импульсом (m
– скорость электрона. Это уравнение, связывающее длину волны с его импульсом (m ), и легло в основу волновой теории электронного строения атома.
), и легло в основу волновой теории электронного строения атома.
Де Бройль предложил рассматривать электрон как стоячую волну, которая должна умещаться на атомной орбите целое число раз, соответствующее номеру электронного уровня. Так, электрону, находящемуся на первом электронном уровне (n = 1), соответствует в атоме одна длина волны, на втором (n = 2) – две и т. д. (рис. 1.9).

Рис. 1.9.
Соотнесение номера атомной орбиты
с колебанием струны
1.5. Орбитали
Внимательное рассмотрение атомных спектров показывает, что «толстые» линии, обусловленные переходами между энергетическими уровнями, на самом деле расщеплены на более тонкие линии. Это означает, что электронные оболочки в действительности расщеплены на подоболочки. Электронные подоболочки обозначают по типам соответствующих им линий в атомных спектрах:
s-подоболочка названа по «резкой» s-линии – sharp;
p-подоболочка названа по «главной» p-линии – principal;
d-подоболочка названа по «диффузной» d-линии – diffuse;
f-подоболочка названа по «фундаментальной» f-линии – fundamental.
Линии, обусловленные переходами между этими подоболочками, испытывают дальнейшее расщепление, если атомы элементов помещены во внешнее магнитное поле. Это расщепление называется эффектом Зеемана. Экспериментально было установлено, что s-линия не расщепляется, р-линия расщепляется на 3, d-линия – на 5, f-линия – на 7.
Согласно принципу неопределенности Гейзенберга положение и импульс электрона не поддаются одновременному определению с абсолютной точностью. Однако, несмотря на невозможность точного определения положения электрона, можно указать вероятность нахождения электрона в определенном положении в любой момент времени. Из принципа неопределенности Гейзенберга вытекают два важных следствия.
1. Движение электрона в атоме – движение без траектории. Вместо траектории в квантовой механике введено другое понятие – вероятность пребывания электрона в определенной части объема атома, которая коррелирует с электронной плотностью при рассмотрении электрона в качестве электронного облака.
2. Электрон не может упасть на ядро. Теория Бора не объяснила это явление. Квантовая механика дала объяснение и этому явлению. Увеличение степени определенности координат электрона при его падении на ядро вызвало бы резкое возрастание энергии электрона до 1011 кДж/моль и больше. Электрон с такой энергией вместо падения на ядро должен будет покинуть атом. Отсюда следует, что усилие необходимо не для того, чтобы удержать электрон от падения на ядро, а для того, чтобы «заставить» электрон находиться в пределах атома.
Функция, зависящая от координат электрона, через которую определяется вероятность его нахождения в той или иной точке пространства, называется орбиталью. Понятие «орбиталь» не следует отождествлять с понятием «орбита», которое используется в теории Бора. Под орбитой в теории Бора понимается траектория (путь) движения электрона вокруг ядра.
Часто принято рассматривать электрон как размытое в пространстве отрицательно заряженное облако с общим зарядом, равным заряду электрона. Тогда плотность такого электронного облака в любой точке пространства пропорциональна вероятности нахождения в ней электрона. Модель электронного облака очень удобна для наглядного описания распределения электронной плотности в пространстве. При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели (рис. 1.10).
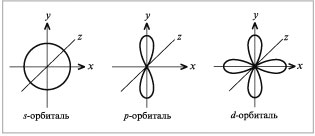
Рис. 1.10.
Формы s-, p- и d-орбиталей
Таким образом, s-подоболочка состоит из одной s-орбитали, p-подоболочка – из трех p-орбиталей, d-подоболочка – из пяти d-орбиталей, f-подоболочка – из семи f-орбиталей.
1.6. Энергетические уровни и
электронная конфигурация атома
Атомные спектры поглощения и испускания однозначно показывают, что все атомы имеют целый ряд возможных энергетических состояний, называемых основным и возбужденными электронными состояниями (рис. 1.11).

Рис. 1.11.
Диаграмма электронных
энергетических состояний атома
Запись распределения электронов в атоме по электронным уровням и подуровням называется его электронной конфигурацией и может быть сделана как для основного, так и возбужденного состояния атома. Для определения конкретной электронной конфигурации атома в основном состоянии существуют следующие три положения.
· Принцип заполнения (наименьшей энергии). Электроны в основном состоянии заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
· Принцип Паули. На любой орбитали может находиться не более двух электронов, причем с противоположно направленными спинами (спин – особое свойство электрона, не имеющее аналогов в макромире, которое упрощенно можно представить как вращение электрона вокруг собственной оси).
· Правило Гунда. Вырожденные (с одинаковой энергией) орбитали заполняются одиночными электронами с одинаково направленными спинами, лишь после этого идет заполнение вырожденных орбиталей электронами с противоположно направленными спинами согласно принципу Паули.
Например, электронная конфигурация атома водорода в основном состоянии записывается в виде:

Для первого возбужденного состояния атома водорода – 2s1, для второго возбужденного состояния – 2p1, для третьего возбужденного состояния – 3s1 и т. д.
Для одноэлектронного атома (водорода) на рис. 1.12 представлены в одинаковом масштабе распределения электронной плотности r в его основном (а) и возбужденных (б, в) состояниях (r – расстояние от электрона до ядра).

Рис. 1.12.
Примерные распределения электронной плотности
для одноэлектронного атома в основном (а) и
возбужденных (б, в) состояниях в зависимости
от расстояния (r) электрона до ядра
Если электронов несколько и они расположены на различных орбиталях в многоэлектронном атоме, происходит проникновение электронной плотности одного электрона на своей орбитали в электронную плотность другого электрона на его орбитали. В качестве примера на рис. 1.13 приведено распределение электронной плотности в трехэлектронном атоме лития, находящемся в основном состоянии.

Рис. 1.13.
Примерное распределение электронной плотности
в трехэлектронном атоме лития для 1s-орбитали
(сплошная линия и для 2s-орбитали (пунктир)
1.7. Магнитные и энергетические
характеристики атомов
Магнитные свойства атомов характеризуют их поведение во внешнем магнитном поле. Если вещество выталкивается из внешнего неоднородного магнитного поля, то атомы этого вещества называют диамагнитными. Если вещество втягивается во внешнее неоднородное магнитное поле, то атомы этого вещества называют парамагнитными.
Диамагнитные свойства вызваны движением спаренных электронов, а парамагнитные – движением неспаренных электронов. Чем больше у атома неспаренных электронов, тем в большей степени проявляется парамагнетизм у вещества.
Особенности электронной структуры различных атомов находят отражение в таких их энергетических характеристиках, как энергия ионизации Еи и сродство к электрону. Их значения принято измерять в килоджоулях на моль (кДж/моль).
Энергия ионизации – минимальная энергия, необходимая для удаления электрона из нейтрального несвязанного (газофазного) атома, находящегося в основном состоянии. Значение Eи всегда является положительным. Например, энергия ионизации атома водорода
Н (г.) = Н+ (г.) + e,
равная +1312,1 кДж/моль, относится к переходу с 1s-атомной орбитали (АО) на АО с n =  , которой отвечает E
, которой отвечает E = 0.
= 0.
У многоэлектронных атомов различают первую (Е1и), вторую (Е2и), третью (Е3и) и т.д. энергии ионизации по последовательному удалению электронов из атома. При этом всегда для одного и того же атома Е1и < Е2и < Е3и, поскольку второй, третий и т.д. электроны приходится отрывать от положительно заряженного иона.
Наибольшими значениями энергии ионизации обладают атомы благородных газов, имеющие полностью заселенные электронные оболочки. Наименьшие значения энергии ионизации имеют атомы щелочных металлов с одним валентным электроном, надежно экранированным от сильного воздействия ядра предыдущими заполненными электронными оболочками.








