ТВЕРДОЕ СОСТОЯНИЕ ВЕЩЕСТВА. ЖИДКИЕ КРИСТАЛЛЫ
Аморфное и кристаллическое состояния веществ
Аморфное и кристаллическое состояния веществ
Вещества в твердом состоянии по строению и свойствам подразделяют на кристаллические и аморфные. Атомы, молекулы или ионы твердых веществ, в
отличие от жидкостей или газов, занимают строго определенное место в пространстве, которое, как вы знаете, называется узлом. Если соединить узлы, в которых находятся частицы твердого вещества, воображаемыми линиями, то получается правильная пространственная решетка, называемая кристаллической.
Вы уже знаете четыре типа кристаллических решеток (ионные, атомные, молекулярные и металлические), можете назвать физические свойства кристаллических
веществ, которые заметно различаются. Однако у них у всех есть одно общее свойство: каждое имеет свою, строго определенную температуру плавления. Что же такое аморфное состояние вещества? Есть вещества, находящиеся в твердом состоянии, подобно кристаллическим веществам, и сохраняющие свою форму достаточно долго. Однако через длительный промежуток времени форма тел, изготовленных из таких веществ, все же изменяется, и это сближает их с жидкостями. Например, восковая свеча, поставленная вертикально, через некоторое время утолщается снизу. Попробуйте проделать нечто подобное с обыкновенной жевательной резинкой или кусочком пластилина. Результат будет таким же. По мере повышения температуры процесс размягчения ускоряется.
веществ, которые заметно различаются. Однако у них у всех есть одно общее свойство: каждое имеет свою, строго определенную температуру плавления. Что же такое аморфное состояние вещества? Есть вещества, находящиеся в твердом состоянии, подобно кристаллическим веществам, и сохраняющие свою форму достаточно долго. Однако через длительный промежуток времени форма тел, изготовленных из таких веществ, все же изменяется, и это сближает их с жидкостями. Например, восковая свеча, поставленная вертикально, через некоторое время утолщается снизу. Попробуйте проделать нечто подобное с обыкновенной жевательной резинкой или кусочком пластилина. Результат будет таким же. По мере повышения температуры процесс размягчения ускоряется.
Определенной температуры плавления у аморфных тел, в отличие от кристаллических, нет. Помните, как у Пушкина: «Вода и камень, лед и пламень»? Камень у поэта – символ твердости. Вы, разумеется, сможете назвать причину этого свойства камня: он – кусочек горной породы и состоит преимущественно из оксида кремния(IV), который имеет атомную кристаллическую решетку, а отсюда и большую твердость. Но так ли все просто в химическом мире? Оказывается, оксид кремния(IV) может быть не только кристаллическим веществом, но также и аморфным. В аморфных веществах образующие его частицы не имеют определенного расположения по всему объему как в кристалле. Они упакованы беспорядочно, и только ближние атомы или молекулы-соседи находятся в некотором порядке друг относительно друга.
В зависимости от условий затвердевания расплава (например, при охлаждении), в аморфном состоянии могут оказаться такие вещества, которые в обычном состоянии имеют кристаллическую структуру. Так, если расплавить кристалл кварца (оксида кремния(IV)), то при быстром охлаждении его образуется аморфный кварц. Он имеет меньшую плотность, чем кристаллический, и широко используется для изготовления различных изделий, в том числе лабораторной посуды.
Аморфное состояние веществ неустойчиво, и рано или поздно они из такого состояния переходят в кристаллическое. Например, в аморфном стекле под влиянием ударных нагрузок образуются мелкие кристаллы, и стекло мутнеет. Застывший твердый мед засахаривается так же, как засахаривается при длительном хранении стекловидная карамель.
Пластическая сера (рис. 1), представляющая собой вещество в аморфном состоянии, через некоторое время превращается в кристаллическую ромбическую серу с молекулярной решеткой.
В зависимости от условий затвердевания расплава (например, при охлаждении), в аморфном состоянии могут оказаться такие вещества, которые в обычном состоянии имеют кристаллическую структуру. Так, если расплавить кристалл кварца (оксида кремния(IV)), то при быстром охлаждении его образуется аморфный кварц. Он имеет меньшую плотность, чем кристаллический, и широко используется для изготовления различных изделий, в том числе лабораторной посуды.
Аморфное состояние веществ неустойчиво, и рано или поздно они из такого состояния переходят в кристаллическое. Например, в аморфном стекле под влиянием ударных нагрузок образуются мелкие кристаллы, и стекло мутнеет. Застывший твердый мед засахаривается так же, как засахаривается при длительном хранении стекловидная карамель.
Пластическая сера (рис. 1), представляющая собой вещество в аморфном состоянии, через некоторое время превращается в кристаллическую ромбическую серу с молекулярной решеткой.
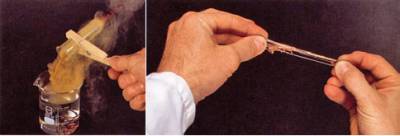
Рис. 1. Получение (а) и свойства пластической серы (б)
Таким образом, вещества в аморфном состоянии по структуре можно рассматривать как очень вязкие жидкости, а по свойствам – как твердые вещества. Аморфное и кристаллическое состояния, являясь двумя крайними полюсами твердого состояния, тем не менее, встречаются одновременно в одном и том же веществе. Многие полимеры, представляя собой в целом аморфные вещества, вместе с тем имеют участки кристаллической структуры. Этим определяется, например, высокая прочность полипропиленового или капронового волокон.
Слово «аморфный» – бесформенный – в сознании многих несет в себе негативный оттенок. Очевидно, это справедливо для характеристики личностных качеств человека.
В мире химических веществ и материалов все наоборот. Именно аморфные вещества являются нам в блеске драгоценного жемчуга, в медовом свечении янтаря, в скромном
обаянии полудрагоценных опала и халцедона, в волшебном многоцветии витражей и мозаики, в изумительной игре света хрусталя и блеске зеркальных витрин (рис. 2).
В мире химических веществ и материалов все наоборот. Именно аморфные вещества являются нам в блеске драгоценного жемчуга, в медовом свечении янтаря, в скромном
обаянии полудрагоценных опала и халцедона, в волшебном многоцветии витражей и мозаики, в изумительной игре света хрусталя и блеске зеркальных витрин (рис. 2).

Рис. 2. Жемчуг (а), янтарь (б), халцедон (в) – аморфные тела, созданные природой. Витражи из цветного стекла (г), мозаика (д), хрусталь (е) – примеры рукотворных аморфных тел
Аморфность – ценное качество полимеров, т.к. оно обуславливает такое их технологическое свойство, как термопластичность. Именно благодаря ей полимер можно вытянуть в тончайшую нить, превратить в прозрачную пленку или отлить в изделие самой замысловатой формы (рис. 3).

Рис. 3. Термопластичность – свойство полимеров, благодаря которому можно изготовить детали конструктора «Лего» различной формы
Существование аморфных тел еще раз доказывает великую философскую истину, что все в мире относительно… Давайте посмотрим на пройденный материал под этим углом зрения.
Относительно деление элементов на металлы и неметаллы. Некоторые из элементов обладают пограничными свойствами: это германий, олово, сурьма. Один из наиболее ярких примеров относительности – двойственное положение водорода в периодической системе. Каждому элементу в периодической системе отведено местоположение, строго определенное зарядом его атомного ядра. Единственный элемент, которому в таблице Д.И.Менделеева отведено сразу два места, причем в резко противоположных
группах (щелочных металлов и галогенов) – это водород. Причины такого особенного отношения к водороду можно отразить с помощью таблицы (табл. 1).
группах (щелочных металлов и галогенов) – это водород. Причины такого особенного отношения к водороду можно отразить с помощью таблицы (табл. 1).
Таблица 1
Положение водорода в периодической системе
| Формы существования во- дорода как элемента | Признаки сход- ства со щелочны- ми металлами | Признаки сход- ства с галогенами |
| Атомы | Имеет на внешнем (и единственном) электронном слое один электрон и относится к s-элементам. Проявляет поэтому восстанови- тельные свойства | До завершения внешнего (и единственного) электронного слоя атому водо- рода недостает одного электрона. Поэтому он может проявлять окислительные свойства |
| Простые вещества | Получен металлический водо- род с металлической кристалли- ческой решеткой и электронной проводимостью | При обычных условиях Н2 – газ, подобно фтору и хлору. Имеет двухатомную молекулу за счет ковалентной химической связи |
| Сложные вещества | В подавляющем большинстве соединений у водорода степень окисления +1 (например, +1 –1 HCl) | С некоторыми металлами образует твердые солеподобные вещества часто ионного типа – гидриды, в которых имеет степень окисления –1 (например, +2 –1 CaH2) |
Деление химической связи на типы носит условный характер, т.к. все эти типы характеризуются определенным единством. Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных
электронов и электростатическое притяжение между этими электронами и ионами металлов. В веществах не часто присутствуют предельные случаи химической связи. Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80 % ионная и на 20 % ковалентная. Правильнее поэтому говорить о степени полярности (ионности) химической связи.
Связи разных типов могут содержаться в одних и тех же веществах, например:
1) в основаниях – между атомами кислорода и водорода в гидроксигруппах ковалентная полярная, а между металлом и гидроксигруппой – ионная;
2) в солях кислородсодержащих кислот – между атомами неметалла и кислородом кислотного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
3) в солях аммония – между атомами азота и водорода – ковалентная полярная, а между ионами аммония и кислотным остатком – ионная;
4) в пероксидах металлов (например, Na2O2) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная; и т.д.
Различные типы связей могут переходить одна в другую: при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь превращается в ионную; при испарении металлов ме- таллическая связь превращается в ковалентную неполярную.
Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа – электронно-ядерное взаимодействие, сопровождающееся выделением энергии.
Относительна взаимообусловленность физических свойств веществ и типа их кристаллической решетки. Так, например, немало веществ с атомной кристаллической решеткой, отнюдь не характеризующихся твердостью (графит, красный фосфор). Некоторые вещества с ионной кристаллической решеткой легкоплавки, например селитры – нитраты щелочных металлов.
Относительно деление веществ на типы по их агрегатному состоянию. Вы знаете о существовании жидких кристаллов, сочетающих в себе структуру кристаллического вещества и свойства жидкостей.
Жидкие кристаллы
В настоящее время насчитывается несколько тысяч веществ, образующих жидкие кристаллы. Жидкокристаллическое состояние присуще таким соединениям, молекулы которых имеют удлиненную линейную форму. Для них направление осей молекулпо одному из трех направлений в пространстве, центры же масс молекул расположены беспорядочно. Изучение жидких кристаллов показало, что их свойства изменяются в зависимости от температуры, длины волны внешнего излучения, механической деформации, электрического и магнитного полей. Это определяет возможность их широкого применения в системах хранения и обработки информации, в индикаторах и т.п.
Одним из свойств жидких кристаллов, нашедших широкое применение, является зависимость их цвета от температуры. Это свойство позволяет использовать их для выявления структурных дефектов непрозрачных объектов: благодаря неодинаковой теплопроводности дефекты вызывают различные цветовые эффекты в пленке жидкого кристалла.
На основе жидких кристаллов разработаны приборы, позволяющие изменять падающий световой поток, – модуляторы. Модулятор состоит из пленки жидкого кристалла, расположенной между прозрачными электродами, и диафрагмы, роль которой может играть оправа чувствительного слоя приемника. Напряжение, подаваемое на жидкий кристалл, изменяет степень рассеяния им падающего света; при этом коэффициент рассеяния в некоторых пределах линейно зависит от напряжения. Изменяя определенным образом напряжение, меняют прозрачность слоя жидкого кристалла и, соответственно, – поток проходящего излучения.
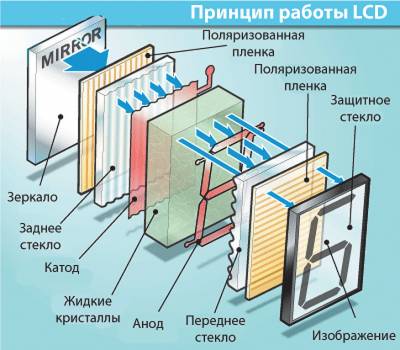
Жидкие кристаллы, оптические свойства которых изменяются под действием электрического поля, используются в цифровых индикаторах (часы, калькуляторы и т.п.). Принцип работы таких индикаторов следующий. Жидкокристаллическое вещество помещается между черной металлической пластиной и тонкой прозрачной для света металлической пленкой, нанесенной на покровное стекло. Черная металлическая пластина и тонкая пленка образуют конденсатор. Если на его обкладках напряжения нет, то свет проходит через жидкий кристалл и поглощается черной пластинкой. Циферблат выглядит черным. Если к обкладкам конденсатора приложено напряжение, то жидкий
кристалл рассеивает свет и становится непрозрачным. В этом случае циферблат будет светиться в тех местах, где создано электрическое поле. Если верхняя пленка
имеет форму цифры, то и область свечения получится в виде цифры (рис. 4).
электронов и электростатическое притяжение между этими электронами и ионами металлов. В веществах не часто присутствуют предельные случаи химической связи. Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80 % ионная и на 20 % ковалентная. Правильнее поэтому говорить о степени полярности (ионности) химической связи.
Связи разных типов могут содержаться в одних и тех же веществах, например:
1) в основаниях – между атомами кислорода и водорода в гидроксигруппах ковалентная полярная, а между металлом и гидроксигруппой – ионная;
2) в солях кислородсодержащих кислот – между атомами неметалла и кислородом кислотного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
3) в солях аммония – между атомами азота и водорода – ковалентная полярная, а между ионами аммония и кислотным остатком – ионная;
4) в пероксидах металлов (например, Na2O2) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная; и т.д.
Различные типы связей могут переходить одна в другую: при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь превращается в ионную; при испарении металлов ме- таллическая связь превращается в ковалентную неполярную.
Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа – электронно-ядерное взаимодействие, сопровождающееся выделением энергии.
Относительна взаимообусловленность физических свойств веществ и типа их кристаллической решетки. Так, например, немало веществ с атомной кристаллической решеткой, отнюдь не характеризующихся твердостью (графит, красный фосфор). Некоторые вещества с ионной кристаллической решеткой легкоплавки, например селитры – нитраты щелочных металлов.
Относительно деление веществ на типы по их агрегатному состоянию. Вы знаете о существовании жидких кристаллов, сочетающих в себе структуру кристаллического вещества и свойства жидкостей.
Жидкие кристаллы
В настоящее время насчитывается несколько тысяч веществ, образующих жидкие кристаллы. Жидкокристаллическое состояние присуще таким соединениям, молекулы которых имеют удлиненную линейную форму. Для них направление осей молекулпо одному из трех направлений в пространстве, центры же масс молекул расположены беспорядочно. Изучение жидких кристаллов показало, что их свойства изменяются в зависимости от температуры, длины волны внешнего излучения, механической деформации, электрического и магнитного полей. Это определяет возможность их широкого применения в системах хранения и обработки информации, в индикаторах и т.п.
Одним из свойств жидких кристаллов, нашедших широкое применение, является зависимость их цвета от температуры. Это свойство позволяет использовать их для выявления структурных дефектов непрозрачных объектов: благодаря неодинаковой теплопроводности дефекты вызывают различные цветовые эффекты в пленке жидкого кристалла.
На основе жидких кристаллов разработаны приборы, позволяющие изменять падающий световой поток, – модуляторы. Модулятор состоит из пленки жидкого кристалла, расположенной между прозрачными электродами, и диафрагмы, роль которой может играть оправа чувствительного слоя приемника. Напряжение, подаваемое на жидкий кристалл, изменяет степень рассеяния им падающего света; при этом коэффициент рассеяния в некоторых пределах линейно зависит от напряжения. Изменяя определенным образом напряжение, меняют прозрачность слоя жидкого кристалла и, соответственно, – поток проходящего излучения.
Жидкие кристаллы, оптические свойства которых изменяются под действием электрического поля, используются в цифровых индикаторах (часы, калькуляторы и т.п.). Принцип работы таких индикаторов следующий. Жидкокристаллическое вещество помещается между черной металлической пластиной и тонкой прозрачной для света металлической пленкой, нанесенной на покровное стекло. Черная металлическая пластина и тонкая пленка образуют конденсатор. Если на его обкладках напряжения нет, то свет проходит через жидкий кристалл и поглощается черной пластинкой. Циферблат выглядит черным. Если к обкладкам конденсатора приложено напряжение, то жидкий
кристалл рассеивает свет и становится непрозрачным. В этом случае циферблат будет светиться в тех местах, где создано электрическое поле. Если верхняя пленка
имеет форму цифры, то и область свечения получится в виде цифры (рис. 4).
Рис. 4. Если к обкладкам конденсатора приложено напряже-
ние, то жидкокристаллическое вещество между ними меняет
свои свойства
ние, то жидкокристаллическое вещество между ними меняет
свои свойства
Жидкие кристаллы играют большую роль в жизнедеятельности человеческого организма. Так, белок, входящий в состав мышечной ткани, обладает способностью образовывать жидкие кристаллы. Гладкие и полосатопоперечные мышечные волокна имеют структуру жидкого кристалла, благодаря чему могут растягиваться и сжиматься, не разрушаясь. Вещество коллаген, содержащееся в опорных тканях (кости, сухожилия) и в мозге, также близко по структуре к жидким кристаллам. Мозг человека по своей природе представляет сложную жидкокристаллическую систему. В белом веществе мозга и проводящих путях нервной системы жидкие кристаллы играют роль диэлектриков.
Форма жидких кристаллов наиболее удобна для протекания биологических процессов. Она соединяет в себе устойчивость к внешним воздействиям с необычайной пластичностью, гибкостью.
Жидкокристаллические волокнистые образования обладают значительной прочностью, что необходимо для опорных тканей. Помимо этого, жидкокристаллическое состояние очень чувствительно ко всем внутриклеточным процессам. Это объясняет, почему жидкие кристаллы обнаруживаются в важнейших функциональных участках клетки.
Огромное количество примеров относительности явлений можно привести из биологии. Вспомним лишь некоторые из курса естествознания 10-го класса: вирусы – своеобразный мостик между живой и неживой природой. Они проявляют свойства живых организмов, лишь попадая в клетку. Подобно живым организмам, вирусы, зацепившись за оболочку клетки, растворяют ее и впрыскивают в клетку свою нуклеиновую кислоту. Эта РНК или ДНК заставляет клетку хозяина производить многочисленные копии вируса. Вне клетки вирусы представляют собой кристаллические вещества, напоминая объекты неживой природы. Другой пример связан с эвгленой зеленой. Она иллюстрирует относительность принадлежности простейших к животным: подобно растениям, она содержит хлоропласты, и на свету, как и растения, способна
синтезировать органические вещества из углекислого газа и воды, т.е. осуществлять фотосинтез.Замечательной физической иллюстрацией относительности истины служит теория, которая так и называется – теория относительности А.Эйнштейна. Приведены всего лишь некоторые примеры относительности ряда ключевых естественно-научных
понятий. Мы преследовали цель помочь вам на материале естествознания сформировать убеждение в том, что в окружающем нас мире не так много абсолютных истин, этот мир нарисован не только черной и белой красками. Мир, в котором мы живем, многолик, многогранен, многоцветен и бесконечно прекрасен.
?
Форма жидких кристаллов наиболее удобна для протекания биологических процессов. Она соединяет в себе устойчивость к внешним воздействиям с необычайной пластичностью, гибкостью.
Жидкокристаллические волокнистые образования обладают значительной прочностью, что необходимо для опорных тканей. Помимо этого, жидкокристаллическое состояние очень чувствительно ко всем внутриклеточным процессам. Это объясняет, почему жидкие кристаллы обнаруживаются в важнейших функциональных участках клетки.
Огромное количество примеров относительности явлений можно привести из биологии. Вспомним лишь некоторые из курса естествознания 10-го класса: вирусы – своеобразный мостик между живой и неживой природой. Они проявляют свойства живых организмов, лишь попадая в клетку. Подобно живым организмам, вирусы, зацепившись за оболочку клетки, растворяют ее и впрыскивают в клетку свою нуклеиновую кислоту. Эта РНК или ДНК заставляет клетку хозяина производить многочисленные копии вируса. Вне клетки вирусы представляют собой кристаллические вещества, напоминая объекты неживой природы. Другой пример связан с эвгленой зеленой. Она иллюстрирует относительность принадлежности простейших к животным: подобно растениям, она содержит хлоропласты, и на свету, как и растения, способна
синтезировать органические вещества из углекислого газа и воды, т.е. осуществлять фотосинтез.Замечательной физической иллюстрацией относительности истины служит теория, которая так и называется – теория относительности А.Эйнштейна. Приведены всего лишь некоторые примеры относительности ряда ключевых естественно-научных
понятий. Мы преследовали цель помочь вам на материале естествознания сформировать убеждение в том, что в окружающем нас мире не так много абсолютных истин, этот мир нарисован не только черной и белой красками. Мир, в котором мы живем, многолик, многогранен, многоцветен и бесконечно прекрасен.
?
1. Чем характеризуется строение твердых веществ? Что их отличает от жидкостей и газов?
2. На какие группы по типу кристаллической решетки можно разделить твердые вещества?
3. Чем отличаются и что общего у аморфных веществ и кристаллических? Что у них общего с жидкостями?
4. Назовите известные вам аморфные вещества и укажите области их применения.
5. Подготовьте сообщение на тему «История стекла в человеческой цивилизации» с использованием ресурсов Интернета.
6. Охарактеризуйте социальный и химический смысл термина «аморфный».
7. Докажите относительность признаков различных классификаций в химии, биологии и физике на основе изученного ранее материала.
8. Приведите примеры относительности характеристик литературных героев, как положительных, так и отрицательных.
9. По материалам средств массовой информации покажите относительность выгодности экономических и политических межгосударственных союзов.
10. Что представляют собой жидкие кристаллы? Какие их типы различают? Что объединяет жидкие кристаллы с жидкостями, а что – с твердыми веществами? Где применяются жидкие кристаллы?
11. На основе курса естествознания прошлого года или воспользовавшись возможностями Интернета, приведите другие примеры из области биологии об относительности истины, кроме упомянутых в параграфе. Расскажите более подробно о примерах, названных в параграфе.
12. На основе курса естествознания прошлого года или воспользовавшись возможностями Интернета, приведите другие примеры из области физики об относительности истины.
2. На какие группы по типу кристаллической решетки можно разделить твердые вещества?
3. Чем отличаются и что общего у аморфных веществ и кристаллических? Что у них общего с жидкостями?
4. Назовите известные вам аморфные вещества и укажите области их применения.
5. Подготовьте сообщение на тему «История стекла в человеческой цивилизации» с использованием ресурсов Интернета.
6. Охарактеризуйте социальный и химический смысл термина «аморфный».
7. Докажите относительность признаков различных классификаций в химии, биологии и физике на основе изученного ранее материала.
8. Приведите примеры относительности характеристик литературных героев, как положительных, так и отрицательных.
9. По материалам средств массовой информации покажите относительность выгодности экономических и политических межгосударственных союзов.
10. Что представляют собой жидкие кристаллы? Какие их типы различают? Что объединяет жидкие кристаллы с жидкостями, а что – с твердыми веществами? Где применяются жидкие кристаллы?
11. На основе курса естествознания прошлого года или воспользовавшись возможностями Интернета, приведите другие примеры из области биологии об относительности истины, кроме упомянутых в параграфе. Расскажите более подробно о примерах, названных в параграфе.
12. На основе курса естествознания прошлого года или воспользовавшись возможностями Интернета, приведите другие примеры из области физики об относительности истины.