Ковалентная связь. Полярная и неполярная ковалентные связи
КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl2:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl2:

Структурная формула молекулы Cl2:
σ
Cl – Cl , σ (p – p) - одинарная связь
σ
Cl – Cl , σ (p – p) - одинарная связь

Рассмотрим механизм образования молекулы кислорода:
О2 – кнс.
О2 – кнс.
Электронная схема образования молекулы О2:

Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p – p)

и одна π (р – р)

Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
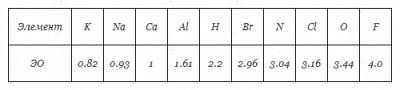
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Самый электроотрицательный элемент – фтор F.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Самый электроотрицательный элемент – фтор F.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:

Структурная формула молекулы НCl:
σ
Н → Cl ,
σ
Н → Cl ,
σ (s – p)
- одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)

Закрепление
№1. Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями: H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
№2. Напишите механизм образования молекул с ковалентным типом связи, определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
№1. Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями: H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
№2. Напишите механизм образования молекул с ковалентным типом связи, определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
 Ковалентная связь.doc (1026k)
Ковалентная связь.doc (1026k)