преподаватель НОУ гимназия «Переделкино», кандидат химических наук
Окисление углеводородов. Подбор коэффициентов методом полуреакций
В молекулах алканов содержатся только высокопрочные σ-связи, которые разрываются в жестких условиях. При их полном окислении (горении) образуются углекислый газ и вода.
По сравнению с алканами алкены окисляются достаточно легко, что объясняется наличием в их молекулах менее прочной π-связи. Продукты окисления алкенов могут быть разными в зависимости от условий проведения реакции и природы исходного алкена. В связи с этим различают мягкое окисление и жёсткое (окислительная деструкция). Мягкое окисление чаще всего осуществляют с помощью водного раствора перманганата калия в нейтральной или слабощелочной среде без нагревания или даже при охлаждении. Жёсткое окисление проводят в следующих условиях: 1) в подкисленном (например, серной кислотой) растворе перманганата или дихромата калия; 2) в концентрированном растворе перманганата или дихромата калия при нагревании. Возможно использование других окислителей.
При мягком окислении разрывается только π-связь в молекуле алкена, оба атома углерода присоединяют по гидроксильной группе и образуют гликоли, например, этиленгликоль:
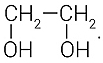
Разберем мягкое окисление алкенов – известную реакцию Вагнера, схема которой:
С2H4 + KMnO4 + H2O → CH2(OH)–CH2(OH) + MnO2 + KOH.
Расставим коэффициенты методом полуреакций.
1. У нас уже записаны молекулярные формулы реагентов и продуктов реакции. Определяем окислитель и восстановитель, среду протекания реакции (кислая, нейтральная, щелочная): С2Н4 – восстановитель, поскольку он получает кислород – окисляется; KMnO4 – окислитель; изначальная среда – нейтральная.
2. Составляем уравнения полуреакций окисления и восстановления (в соответствии с приведенной выше схемой); расставляем коэффициенты так, чтобы соблюдался закон сохранения массы веществ:
процесс окисления: | C2H4 + 2H2O → C2H6O2 + 2H+, |
| процесс восстановления: | MnO4– + 2H2O → MnO2 + 4OH–. |
3. Из левой части полуреакции вычитаем (процесс окисления) или прибавляем (процесс восстановления) столько электронов, сколько необходимо для соблюдения закона сохранения заряда:
процесс окисления: | C2H4 + 2H2O – 2e– → C2H6O2 + 2H+, |
| процесс восстановления: | MnO4– + 2H2O + 3e– → MnO2 + 4OH–. |
4. Находим наименьшее общее кратное числа отданных и принятых электронов и рассчитываем дополнительные множители для полуреакции:

5. Суммируем полуреакции с учётом найденных множителей:
3C2H4 + 6H2O + 2MnO4– + 4H2O → 3C2H6O2 + 2MnO2 + 8OH– + 6H+,
6H+ + 8OH– → 6H2O + 2OH–.
6. Сокращаем одинаковые вещества в правой и левой части уравнения:
3C2H4 + 2MnO4– + 4H2O → 3C2H6O2 + 2MnO2 + 2OH–.
7. Добавляем: 2K+ (левая часть) и 2К+ (правая часть). Записываем уравнение в молекулярном виде, проверяем, чтобы количество всех атомов в левой и
правой частях уравнения было одинаково:
3С2H4 + 2KMnO4 + 4H2O → 3CH2(OH)–CH2(OH) + 2MnO2 + 2KOH.








