ЭЛЕКТРОЛИЗ
Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления элементов, образующих вещества, участвующие в реакции. |
Повторим, что понимается под степенью окисления.
|
Степенью окисления называется условный заряд атомов в химическом соединении, вычисленный, исходя из предположения, что оно состоит только из простых ионов.
|
Для того, чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:
2) степень окисления водорода почти всегда равна +1;
3) степень окисления металлов всегда положительна и в максимальном значении почти всегда равна номеру группы;
4) степень окисления свободных атомов и атомов в простых веществах всегда равна 0;
5) сумма степеней окисления атомов всех элементов в соединении равна 0.
К окислительно-восстановительным относятся все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
Почему эти реакции так называются? Рассмотрим их примеры.
Возьмем красивую и практически важную реакцию алюминотермии: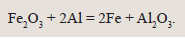
Обозначим степени окисления всех элементов в формулах веществ – реагентов и продуктов этой реакции: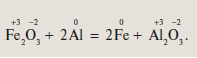
Как видно из уравнения, два элемента – железо и алюминий – изменили свои степени окисления. Что с ними произошло?
Алюминий из нейтрального атома превратился в условный ион в степени окисления +3, т.е. отдал три электрона: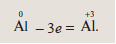
Элементы или вещества, отдающие электроны, называются восстановителями. В ходе реакции они окисляются.
Условный ион железа в степени окисления +3 превратился в нейтральный атом, т.е. получил при этом три электрона: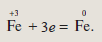
Элементы или вещества, принимающие электроны, называются окислителями. В ходе реакции они восстанавливаются.
Процессы, происходящие в рассмотренном примере, можно представить в виде схемы (схема 1).
Схема 1
Алюминотермия как окислительно-восстановительный процесс
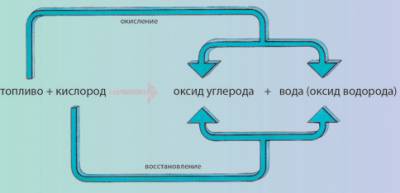
Окислительно-восстановительные процессы сопровождают человека на протяжении всей жизни. Достаточно сказать, что многие биохимические реакции, протекающие в нашем организме, происходят с изменением степеней окисления атомов. Сгорание любого вида топлива в двигателе автомобиля, бойлерной, тепловой электростанции – это тоже окислительно-восстановительные процессы (схема 2).
Схема 2
Горение топлива как окислительно-восстановительный процесс
Наиболее сильными восстановителями являются: металлы, водород, оксид углерода(II), углерод, сероводород, аммиак и др. Наиболее сильные окислители – это фтор, кислород, озон, галогены, азотная и серная кислоты, перманганат калия и др.
Однако самым сильным из известных окислителей и восстановителей является электрический ток. Он восстанавливает даже щелочные и щелочно-земельные металлы и алюминий из их соединений и окисляет анионы галогенов и кислорода до простых веществ.
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через расплав или раствор электролита.
Обратите внимание: к электролитам относятся не только те вещества, растворы которых проводят электрический ток, но и вещества, способные к этому в расплавах.
Если твердое вещество-электролит расплавить, то при переходе в жидкое состояние оно распадается на ионы. При пропускании через расплав электрического тока эти ионы будут направляться к противоположно заряженным электродам и разряжаться на них.
Рассмотрим электролиз расплава хлорида натрия. Эта соль диссоциирует по уравнению: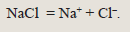
Под действием электрического тока катионы натрия направляются к катоду (отрицательному полюсу источника тока) и разряжаются на нем, присоединяя электроны, т.е. восстанавливаются: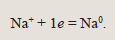
Хлорид-анионы направляются к аноду (положительному полюсу источника тока) и разряжаются на нем – отдают электроны, т.е. окисляются:
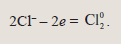
Итоговое уравнение электролиза расплава хлорида натрия:

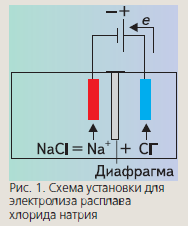 Схематично этот процесс представлен на рис. 1. Именно так в промышленности получают щелочные и щелочно-земельные металлы, а также галогены. Впервые использовал электролиз для получения активных металлов английский химик Г.Дэви (рис. 2).
Схематично этот процесс представлен на рис. 1. Именно так в промышленности получают щелочные и щелочно-земельные металлы, а также галогены. Впервые использовал электролиз для получения активных металлов английский химик Г.Дэви (рис. 2).

Рис. 2. Г.Дэви (1778–1829)
Французский химик А.Муассан (рис. 3) электролизом жидкого фтороводорода впервые получил фтор, который до него безуспешно пытались получить многие химики из
разных стран мира; эти попытки нередко заканчивались трагически. В 1906 г. Муассан за открытие и получение фтора был удостоен Нобелевской премии.
Активные металлы могут быть получены не только из расплавов солей, но и из других соединений, например оксидов. Так, мировая алюминиевая промышленность использует для производства этого металла обезвоженные бокситы (рис. 4).

Рис. 3. А.Муассан
(1852–1907)
Оксид алюминия имеет атомную кристаллическую решетку и является чрезвычайно тугоплавким веществом. Поэтому получение алюминия изначально было очень дорогим. На Парижской выставке 1855 г. алюминий демонстрировался как самый ценный металл. Он был тогда чуть ли не в 10 раз дороже золота. В 1883 г. его выработка во всем мире не достигала и 3 т. Между тем, химикам уже тогда было известно, что алюминий – третий по распространенности в земной коре элемент и самый распространенный в ней металл – на его долю приходится более 8 % массы земной коры. Немногим более ста лет назад американский студент-химик Ч.Холл открыл, что обезвоженные бокситы или глинозем – оксид алюминия можно растворить при 950 °С в расплавленном криолите и затем в результате электролиза выделить из него алюминий.
Рис. 4. Боксит
Удивительно, но в том же 1885 г. французский металлург П.Эру, которому в то время было столько же лет, сколько и Холлу, разработал тот же метод получения алюминия. Метод Холла–Эру сделал возможным промышленное получение этого металла (рис. 5).

Рис. 5. Схема установки для получения алюминия
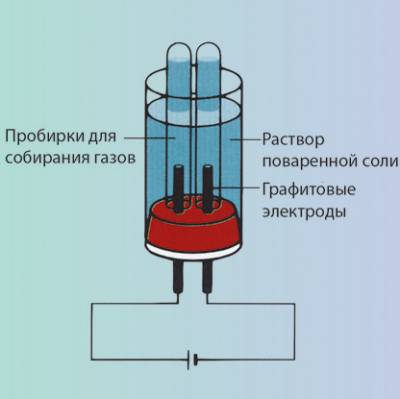
Второй тип электролиза – это электролиз растворов (рис. 6, см. с. 14).
Отличие этого процесса от электролиза расплавов состоит в том, что в системе появляется еще одно вещество – вода. В большинстве случаев она далеко не безразлична к протеканию электрического тока, т.е. наряду с ионами способна окисляться или восстанавливаться на электродах. Не вдаваясь в подробности протекающих на электродах окислительно-восстановительных реакций, запишем суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O ⎯электролиз→ 2NaOH + H2↑ + Cl2↑.
Как видно из уравнения, продуктами электролиза раствора хлорида натрия являются: водород, хлор и гидроксид натрия.
Рис. 6. Схема установки для электролиза раствора
хлорида натрия в лаборатории
В промышленности электролиз широко применяется для:
• получения щелочных, щелочно-земельных металлов и алюминия;
• получения галогенов, водорода, кислорода;
• нанесения металлических покрытий на поверхность изделий – никелирование, хромирование, цинкование (общее название таких процессов – гальваностегия) (рис. 7);
• изготовления рельефных металлических копий (гальванопластика);
• очистки цветных металлов от примесей (рафинирование).
Рис. 7. Гальваностегия. Обыкновенные листья, покрытые
медью, выглядят как украшения
1. Дайте характеристику реакции оксида железа(III) с алюминием по всем возможным признакам классификации реакций.
2. Почему натрий проявляет только восстановительные свойства, а азотная кислота – только окислительные?
3. Что такое электролиз? Назовите продукты электролиза расплава хлорида калия, расплава оксида алюминия, раствора бромида натрия.
4. Подготовьте сообщение на тему «Возникновение и развитие алюминиевой промышленности», используя возможности Интернета.
5. Охарактеризуйте интегрирующую роль алюминиевого производства в мировом экономическом процессе.
6. Назовите предметы домашнего обихода и оборудования квартиры, при изготовлении которых были использованы гальванопластика и гальваностегия.
7. Что называется рафинированием металлов? Приведите примеры. Рассмотрите рафинирование меди, используя возможности Интернета.
8. Подготовьте сообщение на тему «А.Муассан – лауреат Нобелевской премии», используя возможности Интернета.
9. Подготовьте сообщение на тему «Получение и применение галогенов», используя возможности Интернета.
10. Подготовьте сообщение на тему «Жизнь и деятельность Г.Дэви», используя возможности Интернета.