Соли: классификация, номенклатура, химические свойства, способы получения.
Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.

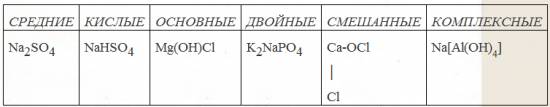
Классификация солей
Чаще всего мы будем работать со средними солями:
Названия солей
для средней соли -
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na2SO4- сульфат натрия,
CuSO4- сульфат меди (II)
для кислой соли –
«гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl - гидроксохлорид магния
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na2SO4- сульфат натрия,
CuSO4- сульфат меди (II)
для кислой соли –
«гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl - гидроксохлорид магния
ПОЛУЧЕНИЕ
1. Из металлов:
металл + неметалл = соль
Fe + S = FeS
металл (металлы до Н2) + кислота (р-р) = соль + Н2
Zn + 2HCl = ZnCl2 + H2
металл (металлы до Н2) + кислота (р-р) = соль + Н2
Zn + 2HCl = ZnCl2 + H2
Металл1 + соль1 = металл2 + соль2
Fe + CuCl2 = FeCl2 + Cu
ВИДЕО "ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С СОЛЯМИ"
Примечание: (металл2 стоит в ряду активности правее)
Примечание: (металл2 стоит в ряду активности правее)

2.Из оксидов:
кислотный оксид + щелочь = соль + вода
SO3 + 2NaOH = Na2SO4 + H2O
основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
основный оксид + кислотный оксид = соль
Na2O + CO2 = Na2CO3
кислотный оксид + щелочь = соль + вода
SO3 + 2NaOH = Na2SO4 + H2O
основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
основный оксид + кислотный оксид = соль
Na2O + CO2 = Na2CO3
3. Реакция нейтрализации:
кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
4. Из солей:
соль1 + соль2 = соль3 + соль4↓
NaCl + AgNO3 = NaNO3 +AgCl ↓
соль1 + щелочь = нерастворимое основание + соль 2
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
соль1 + кислота1 = кислота2 + соль2
2NaCl + H2SO4 = 2HCl + Na2SO4
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода.
соль1 + соль2 = соль3 + соль4↓
NaCl + AgNO3 = NaNO3 +AgCl ↓
соль1 + щелочь = нерастворимое основание + соль 2
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
соль1 + кислота1 = кислота2 + соль2
2NaCl + H2SO4 = 2HCl + Na2SO4
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода.
ТРЕНАЖЁРЫ
Тренажёр №1. "Классы неорганических соединений"
Тренажёр №2. "Классификация солей по растворимости в воде"
Тренажёр №3. "Составление названий солей по формуле"
Тренажёр №4. "Составление формул солей"
Тренажёр №5. Задачи на тему "Расчеты с использованием формул солей"
Физические и химические свойства солей
Физические свойства солей
Соли - это кристаллические вещества разных цветов и разной растворимости в воде. Растворимость соли можно определить по таблице «Растворимость солей, кислот, оснований в воде»

Мел - карбонат кальция
Мрамор - карбонат кальция
Известняк - карбонат кальция
Малахит - гидроксокарбонат меди(II) (CuOH)2CO3 или CuCO3·Cu(ОН)2:
Мрамор - карбонат кальция
Известняк - карбонат кальция
Малахит - гидроксокарбонат меди(II) (CuOH)2CO3 или CuCO3·Cu(ОН)2:



Дихромат аммония - (NH4)2Cr2O7:


Химические свойства
1) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 → СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl→Ag + Cl2.
Исключение. Соли щелочных металлов:
2KClO3 = 2 KCl + 3O2
2КNO3 →2КNO2 + O2
СаСO3 → СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl→Ag + Cl2.
Исключение. Соли щелочных металлов:
2KClO3 = 2 KCl + 3O2
2КNO3 →2КNO2 + O2
Разложение малахита при нагревании:
(CuOH)2CO3 = 2CuO+CO2+H2O
Разложение дихромата аммония при нагревании "Вулкан":
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
(CuOH)2CO3 = 2CuO+CO2+H2O
Разложение дихромата аммония при нагревании "Вулкан":
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
2) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
СaCl2 + H2SO4→ CaSO4 ↓ + 2HCl
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
СaCl2 + H2SO4→ CaSO4 ↓ + 2HCl
3) Взаимодействие со щелочами. Со щелочами реагируют соли, если при этом образуется нерастворимое основание.
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
4) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl → AgCl↓ + NaNO3
5) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 → Cu + FeSO4
AgNO3 + NaCl → AgCl↓ + NaNO3
5) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 → Cu + FeSO4
6) Взаимодействие с кислотными оксидами.
Na2CO3 + SiO2 → СО2 ↑+ Na2SiO3
Na2CO3 + SiO2 → СО2 ↑+ Na2SiO3
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Дайте названия следующим солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
№2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
№3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
№1. Дайте названия следующим солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
№2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
№3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.